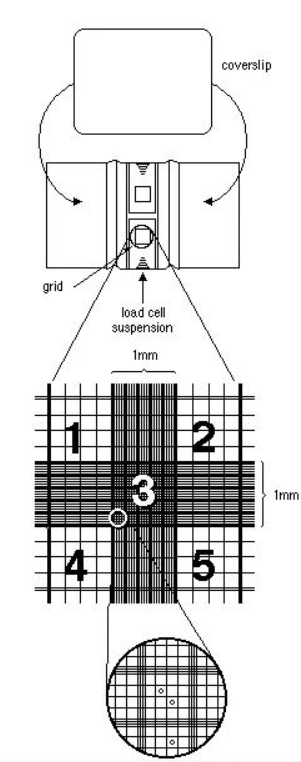
手工细胞计数法1.计数前首先准备好细胞计数器(血球计数板): 使用70%乙醇将盖玻片和细胞计数板清洁、晾干备用。 将晾干的盖玻片轻轻覆盖至血细胞计数器上。 (注:使用前须保证盖玻片和计数板已充分晾干,否则将影响后续细胞充池及计数结果。) 2.制备细胞悬液: 对于贴壁生长的细胞,凯发k8官网需要首先使用胰酶消化的方法使细胞从培养皿表面脱落。(悬浮细胞则无需消化,稀释到合适倍数即可。) 然后加入适当的含血清培养基,中和胰酶的作用并重悬细胞,以得到均质的细胞悬液。要求尽可能将细胞吹散,不要残留任何细胞团,但不可用力过大。 (注:消化太过或消化不全均会使计数结果产生偏差。) 台盼兰染色(可选): 如果需要计算细胞的活率,则需要将细胞悬液和0.4%台盼兰等体积混合; 室温孵育3-5分钟(悬浮细胞染色时间可视情况适当延长),使台盼兰完全进入死细胞,使死细胞着蓝色。 3.充池:即血细胞计数器加样 使用吸管或移液器将细胞悬液或细胞/台盼兰混合液滴加到计数池的边缘。此时液滴将在虹吸的作用下进入盖玻片下方的计数池,此即为充池。 (注:若需进行多个样品的计数,应尽量保证每次充池的体积一致,一般在10μl/池左右。) 以同样的方式在另一侧的计数池中也加入计数样品。 将计数板静置几分钟使细胞扩散、沉降。 4. 细胞计数: 在100倍显微镜下,移动计数板将视野对准计数板的中央大方块,该方块四周有一圈3条平行线包围,中间有密集的网格。中央方块区差不多刚好可以填满整个视野(图1中标记的3号位置)。 分别计数大方格1.2.4.5中的细胞数。(为降低计数误差,最好将细胞浓度调整为20-50个/大方格。)并重复记录另一侧计数池中的细胞数,总计8个大方块,然后取均值。 计数原则为:“数上不数下,数左不数右”。 细胞计数原则 如果有多个细胞没有吹散而成团存在,此时只可记为一个细胞。如果团块很多,则需重新吹打甚至重新取样消化直至绝大多数细胞为单个细胞。 5. 细胞浓度计算: 在常规没有使用台盼兰染色时,可以以下面公式计算每毫升样品中细胞的个数: 每毫升样品中细胞的个数 = 每个大方格内细胞的平均数 × 细胞稀释倍数×104 如果使用了台盼兰染色,还需要计算活细胞的百分率: 活细胞百分率(%)= 台盼兰拒染细胞数/总细胞数×100 此时活细胞数的计算公式为: 每毫升样品中活细胞的个数 = 每个大方格中细胞的平均数×活细胞比率×细胞稀释倍数×2×104 注:乘2是由于在台盼兰染色时,进行了等体积混合,相当于稀释了一倍。
|